甘油三酯(triglycerides, 简称TG)是血液中的脂肪,人体内的TG主要来源于食物和肝脏的合成。过高的甘油三酯是心血管病的独立风险因素,高甘油三酯血症(>1000mg/dL),也增加包括胰腺炎的风险。我们在上一篇介绍了如何通过适当饮食降低甘油三酯,这一篇介绍有什么营养素可以作为辅助手段降低甘油三酯。

烟酸
烟酸是维生素B3,但只有烟酸可以有改善血脂的作用,同为维生素B3的烟酰胺没有。可惜烟酸有副作用,而最为人知的是口服30mg<的烟酸(因人而异),可以导致脸红,包括血管舒张,皮肤瘙痒等症状,但一般不会持续超过30分钟,除了有点不舒服不构成健康问题。但这个副作用使得使用烟酸的人难以坚持,也使得烟酸在治疗高血脂的应用上的局限,而且近年有临床研究发现在使用他汀类药物之上,再使用烟酸好像并没有附加作用(不能降低死亡率),既然都用他汀了,也就不需要烟酸了……… 这个逻辑不在本篇的介绍范围内。
根据美国心脏协会的科学意见,烟酸在降低甘油三酯上非常有效,仅次于贝特类药物,效果优于他汀类药物。[18]
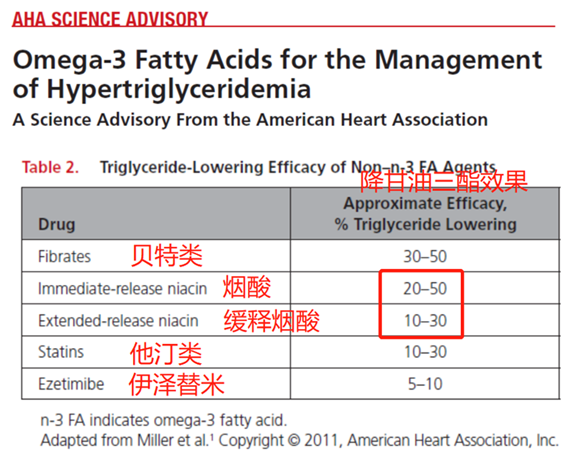
杜克大学在2007年的文献回顾,[19]仔细回顾了过去几十年关于烟酸在治疗高血脂和减甘油三酯的干预研究,建议教育患者关于烟酸会导致脸红的副作用,不需要害怕,而烟酸只有在缓释型中有出现过肝毒性的案例,烟酸只有在短期临床干预研究有出现导致胰岛素抵抗的影响,但对糖尿病人的影响微乎其微,综合来说,烟酸的“印象中”的副作用比实际的大(perception…… of side effects… greater than reality),研究的结论是烟酸在治疗心血管病上没有被充分利用(underused)。
单独使用烟酸可以降低LDL,甘油三酯和提升HDL的临床证据已经有几十年的积累,这里不作详细介绍了。
欧米茄3
人体不能自体合成欧米茄3脂肪酸,必须从食物中获得,而鱼油含有两种对人体最重要的欧米茄3,分别是EPA(二十碳五稀酸)和DHA(廿二碳六烯酸)。鱼油中EPA比DHA对减轻炎症和治疗心血管病更有效。 2019年,首款被美国FDA批准的鱼油处方药是Amarin公司的 Vascepa(品牌)icosapent ethyl(化学名,简称“IPE”),用于辅助治疗心血管病。IPE就是提纯乙酯型的EPA。
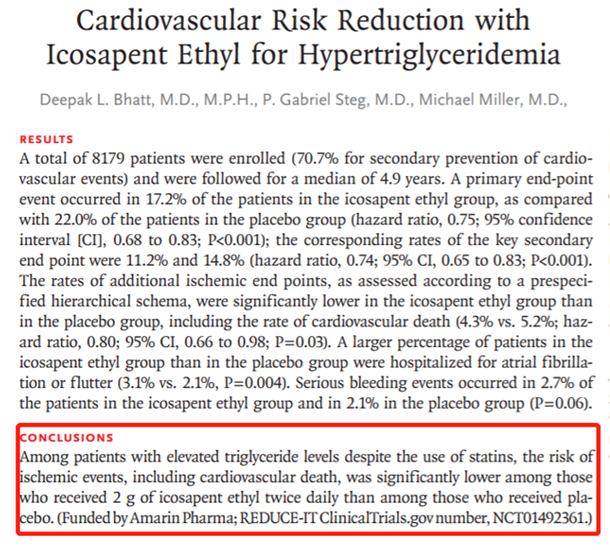
美国FDA批准上述EPA作为处方药,主要基于2019年发表在《新英格兰医学杂志》的双盲对照组临床研究(REDUCE-IT),也是一项新药三期临床试验。[20] 8179人接受干预试验,研究跟踪了受试者接近5年时间,服用上述专利EPA的受试者,心血管病死亡率和风险都比对照组低。研究的结论是,对于使用了他汀类药物但三脂甘油还是高的患者,使用每天2次,每次2g的Vascepa 品牌EPA可以降低心血管事故和降低死亡风险。使用IPE的EPA一年后,受试者的甘油三酯平均降低了18.3%。
美国心脏协会在2019年发表的科学意见, [18] 回顾了10多个对照组临床试验,结论是当单独使用欧米茄3作为治疗高血脂的手段,4g一天的鱼油(3.4g的EPA+DHA),可以平均降低甘油三酯27%,而膳食补充更高剂量的鱼油(4.5 g EPA+DHA)),可以降低甘油三酯39%。当配合他汀类药物一起使用,使用4g的欧米茄3,可以在他汀作用之外额外降低17%-19%的甘油三酯。临床研究发现少于2g一天的EPA+DHA在降低甘油三酯并没有显著效果,而使用2g一天,只能降低甘油三酯5%。
维生素D
2018年的双盲对照组临床研究,[21] 127名糖尿病患者作为研究对象,当中66名为维生素D干预组,他们连续48周每天补充4000IU的维生素D,在试验期后,干预组受试者达到甘油三酯降低了18.74mg/dL,但对改善其他血脂指标没有帮助。
2015年的一项对99名中年糖尿病女性的临床研究,[22]发现连续6个月每天补充4000IU的维生素D,可以降低甘油三酯34.24mg/dL。
2019年的荟萃分析,[23]包括了41个干预研究,一共3434名受试者,发现补充维生素D可以降低甘油三酯,对于维生素D不足人群,补充维生素D可以改善血脂。
不是所有学者都同意补充维生素D可以改善血脂和降低甘油三酯,也有研究支持补充过多维生素D不一定改善心血管病风险,甚至可能有反效果。[24] [25] 但除了干预研究有发现补充维生素D可以降低甘油三酯之外,流行病学研究差不多非常一致地发现维生素D低跟较高的甘油三酯有关,[26] 所以在甘油三酯过高的人群,检查维生素D水平,缺乏(<20ng/ml)或不足(<30ng/ml)的情况下,补充到适当水平,是适当的做法。
维生素C
2018年的一项随机对照组临床研究,[27] 180名受试者分为6组进行试验,分别补充维生素C(500mg),维生素D(2000IU),当中包括进行运动或不运动的,结果发现无论补充维生素C或维生素D都可以简单甘油三酯,维生素降低甘油三酯22.3mg/dL到25mg/dL(维生素C加上运动)。
2021年的双盲对照组临床试验,[28] 比对了高血脂患者喝含1000mg维生素饮料和不含维生素C饮料,4周后的各项血脂指标。维生素C干预组的包括甘油三酯和LDL都显著降低,同时减少身体氧化应激,当中甘油三酯降低了43.7mg/dL。
2018年的荟萃分析,[29] 发现补充维生素C可以显著降低糖尿病患者的甘油三酯,维生素C同时对高血脂高甘油三酯的人群的改善效果更显著。
镁
补充镁对缺乏镁的人可以降低甘油三酯。 镁影响80%人体的代谢功能,大概60%的成年人每天摄入的镁低于建议摄入量,尽管摄入足够的镁,不代表有效吸收,因为镁本身就不是容易被吸收的微量元素,肠道环境影响镁吸收,例如pH值越高,镁就越难以吸收,而pH值在小肠近端到大肠的一直在增加,所以镁在小肠吸收比例高于大肠,而如果胃酸减弱或使用质子泵等药物,pH值在小肠会上升,减少镁的吸收,小肠细菌过度生长也会改变肠道酸碱度,同样影响镁的吸收,而糖和碳水化合物过多需要镁促使胰岛素释放和葡萄糖代谢,增加镁的消耗,肥胖人群一般镁水平较低。 血液中的镁占人体总量少于1%,所以检查血清或血浆镁并不能有效发现是否缺乏镁,使得缺乏镁的情况难以在临床上有效发现,此时补充镁可以改善多种代谢性疾病。 [30]
2018年的双盲对照组临床研究,198名代谢性障碍和缺乏镁的患者作为研究对象,[31]当中100名连续16周每天补充382mg的镁,试验期后,补充镁的干预组的多项代谢性指标改善,包括血糖降低,血压下降,HDL上升,当中甘油三酯下降了61.2mg/dL。
2017年的双盲对照组临床研究,[32] 128名肥胖,糖尿病前期,中度慢性肾脏病(CKD)和缺乏镁的患者接受试验,干预组连续3个月每天补充365mg的镁,试验期后,干预组受试者的胰岛素抵抗改善,HOMA-IR减少了31.9%,药物,尿酸和血脂等同样改善了,而甘油三酯降低了11.84mg/dl,研究的结论是补充镁改善肥胖糖尿病前期的CKD患者的代谢指标。
2014年的双盲对照组临床研究,[33] 47名体重正常但代谢障碍的受试者接受试验,干预组连续4个月每天补充382mg的镁,试验期后这些受试者的胰岛素抵抗指数HOMA-IR降低了46.5%, 空腹血糖改善,收缩压和舒张压也降低了,而甘油三酯降低了47.4%。
其他营养素
2017年的荟萃分析发现槲皮素使用超过50mg,可以显著降低甘油三酯。[34]
2020年的荟萃分析,[35] 包括了12个临床研究,发现补充牛磺酸可以降低血压和胆固醇,也可以降低甘油三酯,平均降低13.05mg/dL。
运动的效果
除了营养素,运动也可以降低甘油三酯,就算是30分钟的带氧运动,都已经有一定效果,而且一天的运动可以降低第二天进食高脂肪饮食的甘油三酯,但运动的效果不能改善甘油三酯超过3天,所以经常运动,但不需要高很高强度的运动,就足以改善甘油三酯。[36] 就算在跑步机上快走60分钟,也可以减低甘油三酯。[37]但同时进行带氧运动和阻力运动,降低甘油三酯的效果更好,一个大型的对照组研究,发现合并运动比对只进行带氧运动,降低甘油三酯多23%。[38]
2019年的临床研究,[39] 19名心脏病患者进行8周的带氧运动干预,发现可以显著减少甘油三酯,而基线甘油三酯越高,运动的作用就越大。
运动对降低甘油三酯和改善代谢性指标都有很多好处,这里不赘述了。
总结
甘油三酯是我们健康的红灯,是重要的代谢性指标,增加心血管病和糖尿病等慢性病的风险,除了通过饮食,补充适当的营养素也可以降低甘油三酯,这一篇介绍过的维生素B3(烟酸),维生素D,维生素C,EPA为主的鱼油,镁等都有临床研究证明可以有效减低甘油三酯,大家可以选择性使用。
免责声明:
本文内容仅作为科普知识提供,不能代替医生的治疗诊断和建议。文章内容中涉及医学的部分均来源于参考文献。
参考
[18] Skulas-Ray, A. C., Wilson, P., Harris, W. S., Brinton, E. A., Kris-Etherton, P. M., Richter, C. K., Jacobson, T. A., Engler, M. B., Miller, M., Robinson, J. G., Blum, C. B., Rodriguez-Leyva, D., de Ferranti, S. D., Welty, F. K., & American Heart Association Council on Arteriosclerosis, Thrombosis and Vascular Biology; Council on Lifestyle and Cardiometabolic Health; Council on Cardiovascular Disease in the Young; Council on Cardiovascular and Stroke Nursing; and Council on Clinical Cardiology (2019). Omega-3 Fatty Acids for the Management of Hypertriglyceridemia: A Science Advisory From the American Heart Association. Circulation, 140(12), e673–e691. https://doi.org/10.1161/CIR.0000000000000709
[19] Guyton, J. R., & Bays, H. E. (2007). Safety considerations with niacin therapy. The American journal of cardiology, 99(6A), 22C–31C. https://doi.org/10.1016/j.amjcard.2006.11.018
[20] Bhatt, D. L., Steg, P. G., Miller, M., Brinton, E. A., Jacobson, T. A., Ketchum, S. B., Doyle, R. T., Jr, Juliano, R. A., Jiao, L., Granowitz, C., Tardif, J. C., Ballantyne, C. M., & REDUCE-IT Investigators (2019). Cardiovascular Risk Reduction with Icosapent Ethyl for Hypertriglyceridemia. The New England journal of medicine, 380(1), 11–22. https://doi.org/10.1056/NEJMoa1
[21] Angellotti, E., D'Alessio, D., Dawson-Hughes, B., Chu, Y., Nelson, J., Hu, P., Cohen, R. M., & Pittas, A. G. (2019). Effect of vitamin D supplementation on cardiovascular risk in type 2 diabetes. Clinical nutrition (Edinburgh, Scotland), 38(5), 2449–2453. https://doi.org/10.1016/j.clnu.2018.10.003
[22] Muñoz-Aguirre, P., Flores, M., Macias, N., Quezada, A. D., Denova-Gutiérrez, E., & Salmerón, J. (2015). The effect of vitamin D supplementation on serum lipids in postmenopausal women with diabetes: A randomized controlled trial. Clinical nutrition (Edinburgh, Scotland), 34(5), 799–804. https://doi.org/10.1016/j.clnu.2014.10.002
[23] Dibaba D. T. (2019). Effect of vitamin D supplementation on serum lipid profiles: a systematic review and meta-analysis. Nutrition reviews, 77(12), 890–902. https://doi.org/10.1093/nutrit/nuz037
[24] Zittermann A. (2018). Vitamin D Status, Supplementation and Cardiovascular Disease. Anticancer research, 38(2), 1179–1186. https://doi.org/10.21873/anticanres.12338
[25] de la Guía-Galipienso, F., Martínez-Ferran, M., Vallecillo, N., Lavie, C. J., Sanchis-Gomar, F., & Pareja-Galeano, H. (2021). Vitamin D and cardiovascular health. Clinical nutrition (Edinburgh, Scotland), 40(5), 2946–2957. https://doi.org/10.1016/j.clnu.2020.12.025
[26] Bouillon R. (2019). Vitamin D and cardiovascular disorders. Osteoporosis international : a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA, 30(11), 2167–2181. https://doi.org/10.1007/s00198-019-05098-0
[27] Farag, H., Hosseinzadeh-Attar, M. J., Muhammad, B. A., Esmaillzadeh, A., & Bilbeisi, A. (2018). Comparative effects of vitamin D and vitamin C supplementations with and without endurance physical activity on metabolic syndrome patients: a randomized controlled trial. Diabetology & metabolic syndrome, 10, 80. https://doi.org/10.1186/s13098-018-0384-8
[28] Basaqr, R., Skleres, M., Jayswal, R., & Thomas, D. T. (2021). The effect of dietary nitrate and vitamin C on endothelial function, oxidative stress and blood lipids in untreated hypercholesterolemic subjects: A randomized double-blind crossover study. Clinical nutrition (Edinburgh, Scotland), 40(4), 1851–1860. https://doi.org/10.1016/j.clnu.2020.10.012
[29] Ashor, A. W., Siervo, M., van der Velde, F., Willis, N. D., & Mathers, J. C. (2016). Systematic review and meta-analysis of randomised controlled trials testing the effects of vitamin C supplementation on blood lipids. Clinical nutrition (Edinburgh, Scotland), 35(3), 626–637. https://doi.org/10.1016/j.clnu.2015.05.021
[30] Workinger, J. L., Doyle, R. P., & Bortz, J. (2018). Challenges in the Diagnosis of Magnesium Status. Nutrients, 10(9), 1202. https://doi.org/10.3390/nu10091202
[31] Rodríguez-Morán, M., Simental-Mendía, L. E., Gamboa-Gómez, C. I., & Guerrero-Romero, F. (2018). Oral Magnesium Supplementation and Metabolic Syndrome: A Randomized Double-Blind Placebo-Controlled Clinical Trial. Advances in chronic kidney disease, 25(3), 261–266. https://doi.org/10.1053/j.ackd.2018.02.011
[32] Toprak, O., Kurt, H., Sarı, Y., Şarkış, C., Us, H., & Kırık, A. (2017). Magnesium Replacement Improves the Metabolic Profile in Obese and Pre-Diabetic Patients with Mild-to-Moderate Chronic Kidney Disease: A 3-Month, Randomised, Double-Blind, Placebo-Controlled Study. Kidney & blood pressure research, 42(1), 33–42. https://doi.org/10.1159/000468530
[33] Rodríguez-Moran, M., & Guerrero-Romero, F. (2014). Oral magnesium supplementation improves the metabolic profile of metabolically obese, normal-weight individuals: a randomized double-blind placebo-controlled trial. Archives of medical research, 45(5), 388–393. https://doi.org/10.1016/j.arcmed.2014.05.003
[34] Sahebkar A. (2017). Effects of quercetin supplementation on lipid profile: A systematic review and meta-analysis of randomized controlled trials. Critical reviews in food science and nutrition, 57(4), 666–676. https://doi.org/10.1080/10408398.2014.948609
[35] Guan, L., & Miao, P. (2020). The effects of taurine supplementation on obesity, blood pressure and lipid profile: A meta-analysis of randomized controlled trials. European journal of pharmacology, 885, 173533. https://doi.org/10.1016/j.ejphar.2020.173533
[36] Graham T. E. (2004). Exercise, postprandial triacylglyceridemia, and cardiovascular disease risk. Canadian journal of applied physiology = Revue canadienne de physiologie appliquee, 29(6), 781–799. https://doi.org/10.1139/h04-051
[37] Dekker, M. J., Graham, T. E., Ooi, T. C., & Robinson, L. E. (2010). Exercise prior to fat ingestion lowers fasting and postprandial VLDL and decreases adipose tissue IL-6 and GIP receptor mRNA in hypertriacylglycerolemic men. The Journal of nutritional biochemistry, 21(10), 983–990. https://doi.org/10.1016/j.jnutbio.2009.08.004
[38] Pitsavos, C., Panagiotakos, D. B., Tambalis, K. D., Chrysohoou, C., Sidossis, L. S., Skoumas, J., & Stefanadis, C. (2009). Resistance exercise plus to aerobic activities is associated with better lipids' profile among healthy individuals: the ATTICA study. QJM : monthly journal of the Association of Physicians, 102(9), 609–616. https://doi.org/10.1093/qjmed/hcp083
[39] Wang, Y., Shen, L., & Xu, D. (2019). Aerobic exercise reduces triglycerides by targeting apolipoprotein C3 in patients with coronary heart disease. Clinical cardiology, 42(1), 56–61. https://doi.org/10.1002/clc.23104















